
替沃扎尼由日本协和麒麟制药公司首先发现,美国Aveo制药公司参与研制。2017年8月,替沃扎尼在欧盟获批,用于治疗晚期肾细胞疾病的成人患者;2021年3月,美国食品和药物管理局批准其上市,用于治疗既往接受过两次或多次全身治疗的复发或难治性晚期肾细胞疾病的成年患者。 2024年3月,卢修斯制药生产的替沃扎尼获得老挝食品药品监督局批准上市。截至2025年,该药尚未在中国大陆地区上市,因此无法享受国内医保报销政策。不过,各地医保政策存在差异,部分地区可能已将替沃扎尼纳入报销范围,建议患者在就医前咨询相关部
替沃扎尼(Tivozanib)是一种新型靶向治疗药物,主要通过抑制血管生成机制发挥抗肿瘤作用,主要适用于特定类型的晚期肾细胞癌患者。 一、替沃扎尼(Tiv...【详情】
替沃扎尼是一款新一代口服血管内皮生长因子(VEGF)酪氨酸激酶抑制剂(TKI),主要用于治疗复发或难治性晚期肾细胞疾病(RCC)。
替沃扎尼
成年复发或难治性晚期肾细胞疾病患者,需接受过至少两种系统性治疗。
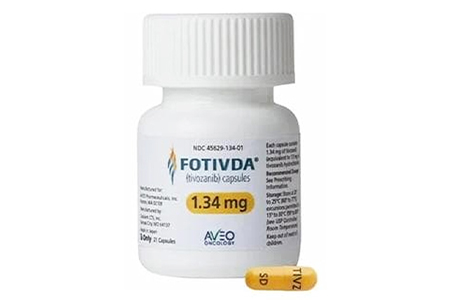
1.34mg胶囊:亮黄色不透明胶囊,帽部印有深蓝色“TIVZ”,体部印有深蓝色“SD”。
0.89mg胶囊:深蓝色不透明胶囊,帽部印有黄色“TIVZ”,体部印有深蓝色“LD”。
【孕妇】禁用。动物研究显示胚胎毒性(畸形、死亡),需在治疗前确认妊娠状态。
【哺乳期女性】治疗期间及末次给药后1个月内禁止哺乳。
【具有生殖潜力的男性和女性】治疗期间及末次给药后1个月内需采取有效避孕措施。可能损害生育能力。
【儿童使用】安全性及有效性尚未明确。
【老年人使用】无需调整剂量,但需密切监测心血管及出血风险。
【肾功能损害】轻度至重度肾损伤(CrCl≥15mL/min)无需调整剂量,终末期肾病数据不足。
【肝功能损害】中度肝损伤需减量至0.89mg,重度肝损伤避免使用。
表现:严重高血压、高血压危象(可能导致死亡)。
处理措施:立即停药,监测血压并支持治疗,无特异性解毒剂。
36个月
保存于20-25°C(允许15-30°C短期波动),避光防潮,置于儿童不可触及处。
吸收:达峰时间(Tmax)中位数10小时,食物不影响生物利用度。
分布:表观分布容积123L,血浆蛋白结合率≥99%。
代谢:主要通过CYP3A4代谢,原型药物占90%。
排泄:79%经粪便排出(26%为原型),12%经尿液排出(原型未检出)。
半衰期:111小时,稳态累积系数6-7倍。
肝损伤影响:中度肝损伤患者AUC增加62%。
免责声明:本页面内容来自公开渠道(如FDA官网、Drugs官网、原研药厂官网等),仅供持有医疗专业资质的人员用于医学药学研究参考,不构成任何治疗建议或药品推荐。所涉药品可能未在中国大陆获批上市,不适用于中国境内销售和使用。如需治疗,请咨询正规医疗机构。本站不提供药品销售或代购服务。
参考资料: